Lo stato di acidosi si ha quindi per un eccesso di acidi o per una carenza di sostanze basiche (bicarbonati) nel plasma e nei liquidi corporei. Un’alterazione anche minima del pH sanguigno in senso acidogeno è pericolosa per la sopravvivenza quindi il corpo trasferisce gli acidi dal sangue al tessuto connettivo e libera dai tessuti (vedi le ossa) verso il sangue, minerali basici per riportare il pH alla giusta proporzione. Il trasferimento di acidi nel connettivo viene definito acidosi extra-cellulare. L’acidosi metabolica si differenzia dall’acidosi respiratoria, in cui vi è una diminuita eliminazione di anidride carbonica. Lo stato di acidosi metabolica si forma fondamentalmente per tre motivi:
-
- accumulo di acidi “fissi” (non volatili cioè trasformatici in acido carbonico ed eliminati dai polmoni), questa è una parte rilevante dell’alimentazione ed è la grande differenza tra l’alimentazione vegetariana/vegana e quella onnivora:
- perdita (vomito, diarrea, sudorazione eccessiva) o carenza di apporto di sostanze alcaline, non volatili, come i bicarbonati, ma anche minerali a reazione basica come, calcio, magnesio, potassio, sodio, zinco; anche in questo caso l’alimentazione vegetariana apporta maggiori quantità di elementi basici rispetti a quelli acidificanti:
- malattie renali con ridotta capacità di eliminazione degli acidi.
Il legame tra acidosi e infiammazione e le sue conseguenze è stato ben definito, cito qui alcuni studi. Nel maggio 2013 un articolo apparso su The Journal of biological chemistry dal titolo
“Extracellular acidosis is a novel danger signal alerting innate immunity via the NLRP3
inflammasome.” di Rajamäki K e coll.. dove si evidenzia come fenomeni di acidosi localizzata a livello extracellulare possa scatenare risposte infiammatorie. In questo studio si è visto che l’ambiente “acido” viene captato dalle cellule immunitarie come un segnale pro infiammatorio. Macrofagi umani sono stati messi in coltura in ambiente da alcalino ad acido (7.5 a 6). L’ambiente acido ha attivato una risposta pH dipendente di secrezione IL-1β e attivazione di caspase-1, sostanze pro infiammatorie della risposta immunitaria innata. L’acidificazione extracellulare ha causato una rapida acidificazione intracellulare. Mentre una soluzione alcalina ha inibito le citochine pro infiammatorie. Questi dati suggeriscono il ruolo pro infiammatorio dell’ambiente acido che rappresenta un nuovo pericoloso segnale endogeno di attivazione dell’immunità innata. Gli autori concludono dicendo che “un pH basso può contribuire all’infiammazione in patologie associate all’acidosi quali l’arteriosclerosi e la risposta infiammatoria post-ischemica”.
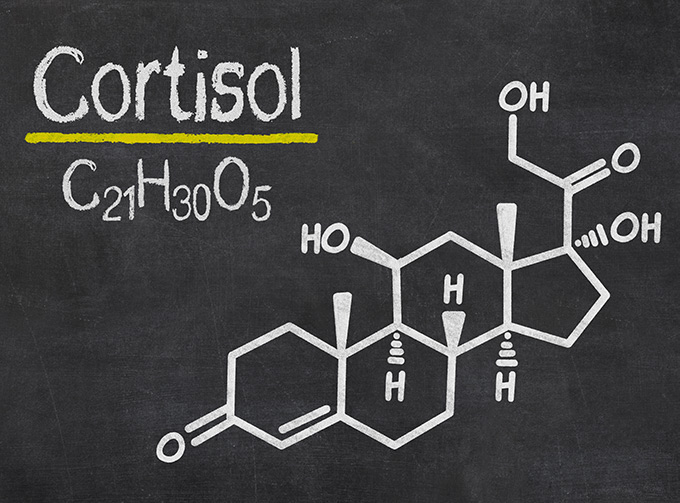
Sulla rivista Inglese Endocrine Journal nell’aprile 2016 firma di Buehlmeier J e coll. è apparso un articolo dal titolo “Glucocorticoid activity and metabolism with NaCl-induced low-grade metabolic acidosis and oral alkalization: results of two randomized controlled trials.”
Un articolo molto interessante che mette in relazione lo stato di acidosi, la risposta infiammatoria e i livelli di cortisolo, inoltre si fa riferimento ad un Low Grade Metabolic Acidosis (LGMA) ossia ad uno stato di acidosi di basso grado, quello ottenibile con un sovraccarico di acidi da alimentazione in particolar modo dalle sostanze più acidificanti, cioè le proteine animali, pesce compreso oppure ad un eccesso di cloruro di sodio. In questi due trial randomizzati si è dimostrato il ruolo dello stato acido o basico sulla risposta conseguente allo stato infiammatorio cioè l’attivazione dei glucocorticoidi. Anche qui, i ricercatori concludono dicendo che “ in caso di ingestione a lungo termine di cibi abituali acidificanti, tipici di un dieta occidentale possono costituire un fattore di rischio indipendente per la perdita di tessuto osseo e le malattie cardiometaboliche.”. In seguito dettaglierò i danni indotti da un eccesso di glucocorticoidi.
Sulla rivista scozzese Clinical Nutrition nell’ottobre 2016 a firma di Williams RS e coll. è apparso un articolo dal titolo “ Dietary acid load, metabolic acidosis and insulin resistance – Lessons from cross-sectional and overfeeding studies in humans” dove si evidenzia come la dieta media occidentale, ricca in proteine animali e povera in vegetali aumenti il carico di sostanze acide e lo stato conseguente di leggera acidosi e come queste siano in relazione anche con lo stato di insulino resistenza.
Nella stessa rivista è apparso nell’aprile 2016 uno studio eseguito da Akter S e coll.. su 1732 lavoratori dal titolo “High dietary acid load is associated with insulin resistance: The Furukawa Nutrition and Health Study” dove si evidenzia come il PRAL (Potential Renal Acid Load) e il NEAP (Net Endogenous Acid Production) indicatori dello stato di acidosi da introiti alimentari sia in relazione all’aumento dell’HOMA IR cioè l’incide di insulino resistenza. Anche in questo caso gli autori concludono dicendo “ I dati presenti suggeriscono che una dieta con un alto carico di acidi è associata con Insulino-Resistenza tra adulti apparentemente sani.”
Concludo questa piccola carrellata di studi sulla relazione tra acidosi, infiammazione e malattie con questo studio apparso nel 2012 sulla rivista Nutrition and Metabolism dal titolo “Examining the relationship between diet-induced acidosis and cancer” di Robey IF.
dove si evidenzia come lo stato di acidosi indotto dalla dieta possa influenzare le attività molecolari a livello cellulare che promuovono la carcinogenesi o la crescita tumorale, in particolare si evidenzia il ruolo dell’acidosi metabolica nella secrezione di cortisolo, di IGF1, le citochine pro infiammatorie degli adipociti, l’attivazione degli osteoclasti e la disregolazione del metabolismo cellulare.
Ci sono centinaia di studi che evidenziano il ruolo potenziale pro infiammatorio della dieta onnivora in contrasto al ruolo antinfiammatorio della dieta vegetariana, questo è un primo passo per capire il motivo per cui una dieta vegetariana garantisce uno stato di salute migliore ossia, in primis, il minor carico di acidi nell’organismo.
Ripristina l’equilibrio acido base con Alka Flor